|

撰文:LDY 责编:DJ

之前研之成理为大家分享了一些催化简史:五十年催化简史
今天再更为详细地补充一下催化理论模型的发展史,希望对大家的催化研究有所帮助。
1.Ostwald的催化定义
Ostwald提出:催化现象是在催化剂作用下化学反应的加速,没有催化剂时反应速率很慢。Catalysis is the acceleration of a chemical reaction, which proceeds slowly, by the presence of a foreign substance…. However, these processes, like all natural ones, must always occur in such a direction that the free energy of the entire system is decreased.
同时他还强调了该反应过程必须是朝体系整体自由能降低的方向进行的。在Ostwald定义了催化现象之后,他于1909年获得了诺贝尔奖。按照今天标准的术语是:
催化剂不能影响一个反应的热力学平衡,只能改变到达平衡的速率。
2.吸附
在1900年左右,人们就认识到催化过程中的吸附作用。Langmuir着重研究了化学吸附,提出了单层化学吸附模型。
而Brunauer, Emmett和 Teller (BET)发展了利用物理吸附来测定催化剂表面积的方法,使得催化剂的活性比较进入定量时代。Taylor也提出“活化吸附”的概念,即从物理吸附态到化学吸附态的转变需要活化能,随后就被Lennard-Jones引入势能图解释从物理吸附到化学吸附的转变过程。

吸附的Lennard-Jones曲线
进一步,Langmuir,Rideal和Hinshelwood等人研究了多种异相催化反应,提出了一套统一的原理来解释许多实验中观察到的速率—压力关系。相应地发展了表面催化反应的Langmuir-Hinshelwood(L-H)机理以及Eley-Rideal(E-R)机理。
在L-H机理中:催化反应速率取决于表面吸附分子间的反应速率,且吸附和脱附过程处于平衡。
而在E-R机理中,适用于一个强吸附的原子/分子与表面弱吸附(如物理吸附)的分子间的反应。
3.Taylor和活性中心理论
1920年左右,H.S Taylor发现在催化剂表面的角、裂纹等不连续的地方会发生优先吸附。他认为这些位点的催化活性会比平坦表面的高。这就是“活性中心”与“活性结构”概念的起源。Taylor的活性中心理论将固体催化剂研究的焦点转移到催化剂表面的不均匀性,也认识到整个催化剂表面不是均等地影响化学反应的。
在此基础上,1940年代中期,Balandin提出所谓的“多位理论(Multiplet theory)”,即催化剂的活性取决于表面上几个空间合适的原子与反应分子的合适匹配,比如环己烷脱氢反应而言,催化剂表面原子晶格间距应该有利于金属—环己烷氢原子之间的键合作用。Kobozev进一步将此概念发展为“集合体(ensemble)”—催化活性原子的最小组合。

Balandin多位理论的图示。该图示显示的是某种环己烷到苯的反应的较好活性金属催化剂的成键。该特定的多位体是一个六重位点(sextet)。
以上的介绍都是基于化学原理进行催化剂的描述,强调了反应分子与催化剂作用的局域性质。值得注意的是,1950年代中期,催化剂的体相电子结构理论曾非常地流行。该理论采用固体物种的能带模型,认为催化剂的性质是有能带决定的。固体中的价电子,可被激发到导带上,而导带上的电子则能迁移至固体表面将吸附物还原(p型半导体),n型半导体则相反。该模型将化学反应中分子间作用与半导体能带性质进行关联,将催化剂的活性差异归因为固体中电子浓度和以费米能级的位置所影响的电子转移程度。因此更多的是基于一种“离域”的电子效应的物理描述,而忽略了反应物与表面间的“局域”相互作用。该模型也难以描述催化剂表面电子结构与体相的差异,在60年代以后,逐渐被摒弃,仅在半导体的光催化中有所应用。
4.中间化合物理论与火山型曲线
而在1920左右,Sabatier提出所谓的中间化合物(intermediate compound)模型,他发现Ni的加氢反应中,Ni之所以有催化活性是因为镍即可以很容易地形成氢化物,也可以分解成为纯金属。基于此,Sabatier提出,如果形成中间化合物过于容易(生成焓大),则随后中间物的分解可能很慢;而若形成中间化合物太过困难,则催化反应速率也会很慢。用于表面吸附上,就是反应速率随着吸附热(中间化合物的生成焓)的增加而提高,但是增加到足够高的时候,中间物的吸附过于强而导致反应速率下降。理想的催化剂就是吸附既不太强,也不太弱,这就是着名的Sabatier原理。因此,在吸附热与中间物生成焓与催化速率的关系图上,往往都是呈现出一种火山型曲线。

甲酸分解活性的火山型曲线:横坐标为金属甲酸盐的生成焓,纵坐标为特定转化率的温度。
在此“中间化合物”假设的基础上,1935年Polanyi发展出了催化的“过渡态”理论。
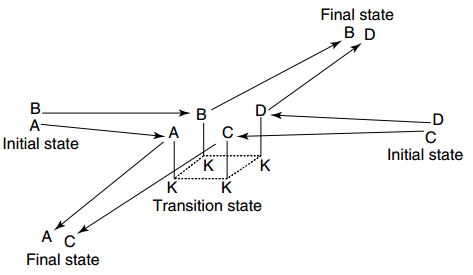
Polanyi的过渡态理论图示。
而Eyring也提出所谓的活化反应速率理论,并将Ostwald的催化定义利用活化络合物的反应坐标在势能图上直观地表现出来。

Ostwald催化定义的势能曲线示意图
在1954年,Mars 和van Krevelen提出氧化物表面的烷烃催化氧化反应的两步机理:
首先氧化物与烷烃进行反应,烷烃分子被氧化,而氧化物被还原;随后还原态氧化物与分子氧反应回归初始态。因此,氧化物中的提供氧的能力是此机理的关键,该机理也称作“晶格氧”机理。在此机理中,氧化物适中的得,失氧的能力还影响着氧化过程的选择性。
5.小结
高度概括的科学模型对实验的指导与机理认识有着巨大的推动作用。一百多年过去了,这些历史上智者发展的科学观点,依然指引着当今催化剂的机理研究。
回首过去,展望未来。欢迎大家大开脑洞,在留言区畅谈一下二十一世纪会出现新的催化模型与理论。
本文主要参考以下资料写就:
1.吴越 (1998). 催化化学 科学出版社.
2.Thomas, J. M. & Thomas, W. J. (2015). Principles and Practice of Heterogeneous Catalysis Wiley-VCH.
3.Gerhard Ertl (Editor), Helmut Knozinger (Editor), Ferdi Schüth (Editor), Jens Weitkamp (Editor (2008). Handbook of heterogeneous catalysis Weinheim: WILEY-VCH.
上一篇:送女儿到美国后,这位曾痛恨中国教育的父亲傻眼了
下一篇:水木书榜 - 写在世界读书日前
|

